При ізобарному процесі робота розширення газу може бути знайдена на діаграмі pV, як площа прямокутника. З графіка випливає, що A = pΔV = p(V2-V1) Робота, що виконана газом, чисельно дорівнює площі під графіком залежності р(V) у тому випадку, коли тиск газу в ході процесу змінюється.
dVdT=RP ⇒ PdVdT=R. Отже, робота одного моля ідеального газу при його ізобарному нагріванні на 1 К чисельно дорівнює універсальній газовій сталій.
Зміна об'єму й температури газу за постійного тиску називається ізобарним процесом. Під час ізобарного процесу об'єм газу прямо пропорційний його абсолютній температурі: V/T =const за p =const. Це співвідношення називають законом Гей-Люссака – на честь французького вченого, який відкрив його на початку ХІХ ст.
Оскільки Sh 1=V 1 – початковий об'єм газу, а Sh 2=V 2 – кінцевий, роботу газу можна записати через зміну об'єму газу: A=pΔV=p(V 2-V 1). Розширюючись, газ виконує додатну роботу, оскільки напрямок сили і напрямок переміщення поршня збігаються. Розширюючись, газ передає енергію навколишнім тілам.
Ізохорний процес – це процес, під час якого об'єм газу не змінюється. Якщо об'єм газу не змінюється, то робота газу дорівнює нулю. А=0 Отже, для ізохорного процесу: Q=∆U=2 к.
ізохорний; ізотермічний. Як змінюється внутрішня енергія ідеального одноатомного газу при ізобарному розширенні? Не змінюється.

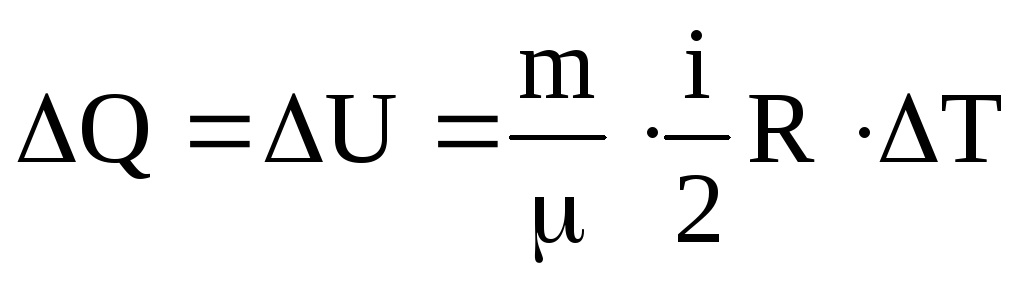
В обох випадках тиск дорівнює атмосферному. При ізобаричному процесі об’єм ідеального газу прямопропорційний температурі (див. Закон Гей-Люссака).